ปฏิกิริยาเคมี และอัตราการเกิดปฏิกิริยาเคมี
Homepage
ปฏิกิริยาเคมี และอัตราการเกิดปฏิกิริยาเคมี
ปฏิกิริยาเคมี
ปฏิกิริยาเคมี คือ กระบวนการเปลี่ยนของสารตั้งต้นไปเป็นสารใหม่ โดยปริมาณสารตั้งต้นจะลดลง และปริมาณสารใหม่จะเกิดขึ้น และเพิ่มปริมาณขึ้นเรื่อยๆ เมื่อเวลาผ่านไป โดยสามารถเขียนให้เข้าใจง่ายด้วยสมการเคมี
ปฏิกิริยาเคมีจำแนกเป็น 2 ประเภท คือ1. ปฏิกิริยาเคมีสมบูรณ์ คือ การเกิดสารใหม่ขณะที่สารตั้งต้นตัวใดตัวหนึ่งหมดไปหรือหมดทุกตัว 2. ปฏิกิริยาเคมีไม่สมบูรณ์ คือ การเกิดสารใหม่ขณะที่สารตั้งต้นยังเหลือทุกตัว ไม่มีตัวใดตัวหนึ่งหมดไป
ทฤษฎีการชนโมเลกุล (Collision Theory) กล่าวถึง โมเลกุลของสารต้องมีการชนซึ่งกันและกัน ซึ่งการชนกันแต่ละครั้งไม่จำเป็นต้องเกิดปฏิกิริยา
1. ต้องมีจำนวนโมเลกุลมากพอ
2. ต้องมีการชนกันระหว่างโมเลกุล
3. ต้องมีพลังงานสูงพอ โดยอย่างน้อยต้องเท่ากับพลังงานก่อกัมมันต์
4. ต้องมีทิศทางที่เหมาะสม
ทฤษฎีจลน์ของโมเลกุล (Kinetic Theory) กล่าวถึง โมเลกุลต้องมีการเคลื่อนที่ช้าลง ซึ่งก่อให้เกิดพลังงานจลน์ โดยโมเลกุลต้องมีพลังงานสูงพอจึงจะเกิดปฏิกิริยาได้
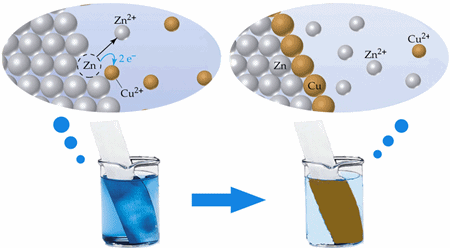
สถานะการเกิดปฏิกิริยาเคมี
ศาสตร์ทางเคมีที่เกี่ยวข้องกับการศึกษาอัตราการเกิดปฏิกิริยาเคมี เรียกว่า จลนศาสตร์เคมี (chemical kinetics) โดยคำว่า จลนศาสตร์ มีความหมายเกี่ยวข้องกับการเคลื่อนที่ของสาร ซึ่งเกี่ยวข้องกับอัตราการเกิดปฏิกิริยาเคมี (Rate of chemical reaction) โดยการเกิดปฏิกิริยาหนึ่งๆที่อยู่ในสภาวะเดียวกันจะมีอัตราการเกิดปฏิกิริยาเฉพาะค่า โดยขึ้นอยู่กับสภาวะธรรมชาติของสารนั้นๆ เช่น อัตราการเกิดปฏิกิริยาของก๊าซไฮโดรเจนกับก๊าซฟลูออรีน และก๊าซไนโตรเจน
ศาสตร์ทางเคมีที่เกี่ยวข้องกับการศึกษาอัตราการเกิดปฏิกิริยาเคมี เรียกว่า จลนศาสตร์เคมี (chemical kinetics) โดยคำว่า จลนศาสตร์ มีความหมายเกี่ยวข้องกับการเคลื่อนที่ของสาร ซึ่งเกี่ยวข้องกับอัตราการเกิดปฏิกิริยาเคมี (Rate of chemical reaction) โดยการเกิดปฏิกิริยาหนึ่งๆที่อยู่ในสภาวะเดียวกันจะมีอัตราการเกิดปฏิกิริยาเฉพาะค่า โดยขึ้นอยู่กับสภาวะธรรมชาติของสารนั้นๆ เช่น อัตราการเกิดปฏิกิริยาของก๊าซไฮโดรเจนกับก๊าซฟลูออรีน และก๊าซไนโตรเจน
H2 (g) + F2 (g) = 2HF อัตราการเกิดปฏิกิริยาเร็ว
3H2 (g) + N2 (g) = 2NH3 อัตราการเกิดปฏิกิริยาช้า
3H2 (g) + N2 (g) = 2NH3 อัตราการเกิดปฏิกิริยาช้า
อัตราการเกิดปฏิกิริยาเคมี
อัตราการเกิดปฏิกิริยาเคมี (Rate of chemical reaction) หมายถึง การเปลี่ยนแปลงปริมาณสารในหนึ่งหน่วยเวลาของการเกิดปฏิกิริยาของสารนั้น
อัตราการเกิดปฏิกิริยาเคมี = ปริมาณสารตั้งต้นที่ลดลง
เวลา
เวลา
อัตราการเกิดปฏิกิริยาเคมี = ปริมาณสารที่เปลี่ยนไป
เวลา
เวลา
อัตราการเกิดปฏิกิริยาเคมี = ปริมาณสารที่เพิ่มขึ้น
เวลา
เวลา
ชนิดอัตราการเกิดปฏิกิริยาเคมี แบ่งเป็น 2 ชนิด
1. อัตราการเกิดปฏิกิริยาเฉลี่ย หมายถึง อัตราการเกิดปฏิกิริยาที่คำนวณจากการเปลี่ยนแปลงปริมาณสารทั้งหมดในหนึ่งหน่วยเวลา
2. อัตราการเกิดปฏิกิริยา ณ ขณะใดขณะหนึ่ง หมายถึง อัตราการเกิดปฏิกิริยาที่คำนวณจากการเปลี่ยนแปลงปริมาณสารในช่วงเวลาใดเวลาหนึ่ง
1. อัตราการเกิดปฏิกิริยาเฉลี่ย หมายถึง อัตราการเกิดปฏิกิริยาที่คำนวณจากการเปลี่ยนแปลงปริมาณสารทั้งหมดในหนึ่งหน่วยเวลา
2. อัตราการเกิดปฏิกิริยา ณ ขณะใดขณะหนึ่ง หมายถึง อัตราการเกิดปฏิกิริยาที่คำนวณจากการเปลี่ยนแปลงปริมาณสารในช่วงเวลาใดเวลาหนึ่ง
สรุปประเด็นที่เกี่ยวข้อง
1. ปฏิกิริยาเคมีหนึ่งๆ จะมีขั้นตอนการเกิดปฏิกิริยาหลายขั้นตอน ทั้งขั้นที่เกิดเร็ว และขั้นที่เกิดช้า โดยมีขั้นสำหรับควบคุมปฏิกิริยาหรือขั้นกำหนดอัตรา (Rate determing step) คือ ขั้นที่ดำเนินไปที่ช้าที่สุด
2. ขณะที่การเกิดปฏิกิริยาเคมีดำเนินไป ปฏิกิริยาเคมีในขั้นเริ่มต้นจะมีอัตราการเกิดที่รวดเร็ว เนื่องจากปริมาณสารตั้งต้นมีมาก และเมื่อปฏิกิริยาผ่านไประยะหนึ่ง อัตราการเกิดปฏิกิริยาจะช้าลงเมื่อเทียบกับในช่วงเริ่มต้น เนื่องจากปริมาณสารตั้งต้นมีปริมาณลดลง
3. สารเคมีแต่ละชนิดในปฏิกิริยาเคมีจะมีอัตราเร็วไม่เท่ากัน
4. การคำนวณหาอัตราการเกิดปฏิกิริยา สามารถหาได้จากสารใดก็ได้ ด้วยวิธี คือ
– หากเป็นของแข็ง สามารถหาได้โดยการชั่งน้ำหนัก
– หากเป็นของเหลว สามารถหาได้โดยการชั่งน้ำหนักหรือการวัดปริมาณ
– หากเป็นสารละลาย สามารถหาได้จากความเข้มข้น
– หากเป็นก๊าซ สามารถหาได้โดยการวัดปริมาตรหรือวัดความดัน 5. การหาอัตราการเกิดปฏิกิริยาเคมี สามารถหาได้จากสารตัวใดตัวหนึ่งก็ได้ ซึ่งจะให้ค่าที่เท่ากัน ตามสูตรด้านล่าง อัตราการเปลี่ยนแปลงของสาร = ΔA ↔ ΔB ↔ ΔC ↔ ΔD –Δt –Δt +Δt +Δt อัตราการเกิดปฏิกิริยาเคมี = ΔA ↔ ΔB ↔ ΔC ↔ ΔD -Δt -3Δt +2Δt +4Δt
1. ปฏิกิริยาเคมีหนึ่งๆ จะมีขั้นตอนการเกิดปฏิกิริยาหลายขั้นตอน ทั้งขั้นที่เกิดเร็ว และขั้นที่เกิดช้า โดยมีขั้นสำหรับควบคุมปฏิกิริยาหรือขั้นกำหนดอัตรา (Rate determing step) คือ ขั้นที่ดำเนินไปที่ช้าที่สุด
2. ขณะที่การเกิดปฏิกิริยาเคมีดำเนินไป ปฏิกิริยาเคมีในขั้นเริ่มต้นจะมีอัตราการเกิดที่รวดเร็ว เนื่องจากปริมาณสารตั้งต้นมีมาก และเมื่อปฏิกิริยาผ่านไประยะหนึ่ง อัตราการเกิดปฏิกิริยาจะช้าลงเมื่อเทียบกับในช่วงเริ่มต้น เนื่องจากปริมาณสารตั้งต้นมีปริมาณลดลง
3. สารเคมีแต่ละชนิดในปฏิกิริยาเคมีจะมีอัตราเร็วไม่เท่ากัน
4. การคำนวณหาอัตราการเกิดปฏิกิริยา สามารถหาได้จากสารใดก็ได้ ด้วยวิธี คือ
– หากเป็นของแข็ง สามารถหาได้โดยการชั่งน้ำหนัก
– หากเป็นของเหลว สามารถหาได้โดยการชั่งน้ำหนักหรือการวัดปริมาณ
– หากเป็นสารละลาย สามารถหาได้จากความเข้มข้น
– หากเป็นก๊าซ สามารถหาได้โดยการวัดปริมาตรหรือวัดความดัน 5. การหาอัตราการเกิดปฏิกิริยาเคมี สามารถหาได้จากสารตัวใดตัวหนึ่งก็ได้ ซึ่งจะให้ค่าที่เท่ากัน ตามสูตรด้านล่าง อัตราการเปลี่ยนแปลงของสาร = ΔA ↔ ΔB ↔ ΔC ↔ ΔD –Δt –Δt +Δt +Δt อัตราการเกิดปฏิกิริยาเคมี = ΔA ↔ ΔB ↔ ΔC ↔ ΔD -Δt -3Δt +2Δt +4Δt
หมายเหตุ: Δ = ผลต่าง, t = เวลา, + = การเพิ่มขึ้น, – = การลดลง
6. อัตราการเกิดปฏิกิริยาเคมีจะเท่ากับอัตราการเปลี่ยนแปลงของโมลสารหารด้วยหารด้วยสัมประสิทธิ์จำนวนโมลของสารนั้นที่ได้จากการดุลสมการแล้ว
กฏอัตรา
กฏอัตรา คือ สมการที่แสดงความสัมพันธ์ระหว่างอัตราการเกิดปฏิกิริยาเคมีกับความเข้มข้นของสารตั้งต้นหรือสารที่เข้าทำปฏิกิริยา เช่น
2A + 3B + C = 2D
อัตรา (Rate) = -1 d(A) = -1 d(B) = –d(C) = -1 d(D)
2 dt 3 dt dt 2 dt
2 dt 3 dt dt 2 dt
อัตราการเกิดปฏกิริยาเคมี (rate) = k(A)x (B)y (C)z
หมายเหตุ:
k = ค่าคงที่ของปฏิกิริยา (specific rate constant) และค่า k จะเปลี่ยนเมื่อ t เปลี่ยน โดยค่า k มีค่ามากแสดงถึงอัตราการเกิดปฏิกิริยาที่ดี
x,y,z = ลำดับการเกิดปฏิกิริยาเมื่อเทียบกับความเข้มข้นของสาร A, B และC
(A) (B) (C) = ความเข้มข้นของสาร A, B และC หน่วย โมล/ลิตร
x + y + z = ลำดับรวมของปฏิกิริยา (order of reaction)
k = ค่าคงที่ของปฏิกิริยา (specific rate constant) และค่า k จะเปลี่ยนเมื่อ t เปลี่ยน โดยค่า k มีค่ามากแสดงถึงอัตราการเกิดปฏิกิริยาที่ดี
x,y,z = ลำดับการเกิดปฏิกิริยาเมื่อเทียบกับความเข้มข้นของสาร A, B และC
(A) (B) (C) = ความเข้มข้นของสาร A, B และC หน่วย โมล/ลิตร
x + y + z = ลำดับรวมของปฏิกิริยา (order of reaction)
ทั้งนี้ ลำดับปฏิกิริยาจะหาได้จากการทดลองเท่านั้น โดยไม่มีความสัมพันธ์กับตัวเลขด้านหน้าของสารของสสมการเคมีที่ดุลแล้ว
ปัจจัยที่มีผลต่อการเกิดปฏิกิริยาเคมี
1. ธรรมชาติของสารตั้งต้น และผลิตภัณฑ์
ความเร็วหรือช้าของการเกิดปฏิกิริยาเคมีจะขึ้นอยู่กับสภาพธรรมชาติของสารเหล่านั้น เช่น สารประเภทไอออนิกที่เข้าทำปฏิกิริยากันจะเกิดความเร็วของปฏิกิริยาได้ดีกว่าสารที่เป็นโควาเลนท์ หรือสารทำปฏิกิริยาที่เป็นก๊าซจะทำปฏิกิริยาได้เร็วกว่าสารที่มีสถานะอื่น
2. ความเข้มข้นสารตั้งต้น และผลิตภัณฑ์
ความเร็วของปฏิกิริยาจะแปรผันตามความเข้มข้นของสารตั้งต้น และจะแปรผกผันกับความเข้มข้นของสารผลิตภัณฑ์ กล่าวคือ เมื่อปริมาณสารตั้งต้นมีมากอัตราการเกิดปฏิกิริยาก็จะเร็ว และเมื่อเวลาผ่านไปปริมาณสารตั้งต้นลดลง ปฏิกิริยาก็จะค่อยๆลดลงตามปริมาณผลิตภัณฑ์ที่เพิ่มขึ้น
3. พื้นที่ผิว
พื้นที่ผิวของสารจะเป็นจุดของการเกิดปฏิกิริยา หากสารมีพื้นที่ผิวมากก็จะทำให้เกิดปฏิกิริยาได้เร็วขึ้น เช่น การทำปฏิกิริยาของหินปูนกับกรดไฮโดรคลอริกจะได้ก๊าซคาร์บอนไดออกไซด์ หากหินปูนมีความละเอียดเป็นผงขนาดเล็ก มีพื้นที่ผิวมากก็ย่อมทำปฏิกิริยากับกรดไฮโดรคลอริกได้อย่างรวดเร็ว
4. อุณหภูมิ
อุณหภูมิถือเป็นปัจจัยหนึ่งที่ช่วยกระตุ้นความเร็วของการเกิดปฏิกิริยา เช่น การอุ่นน้ำมันด้วยความร้อนเพียงน้อยนิดจะทำให้น้ำมันอุ่นเท่านั้น แต่หากเพิ่มความร้อนจนทำให้น้ำมันกลายเป็นไอก็สามารถลุกติดไฟได้ง่าย
5. ความดัน
ความดันที่เกี่ยวข้องกับอัตราการเกิดปฏิกิริยาเคมีมักพบมากในสารที่เป็นก๊าซ เพราะการเพิ่มความดันให้ก๊าซจะทำให้โมเลกุลของก๊าซเกิดการชนกันมากขึ้น
แหล่งอ้างอิง : https://www.siamchemi.com/%E0%B8%9B%E0%B8%8F%E0%B8%B4%E0%B8%81%E0%B8%B4%E0%B8%A3%E0%B8%B4%E0%B8%A2%E0%B8%B2%E0%B9%80%E0%B8%84%E0%B8%A1%E0%B8%B5/
ความเร็วหรือช้าของการเกิดปฏิกิริยาเคมีจะขึ้นอยู่กับสภาพธรรมชาติของสารเหล่านั้น เช่น สารประเภทไอออนิกที่เข้าทำปฏิกิริยากันจะเกิดความเร็วของปฏิกิริยาได้ดีกว่าสารที่เป็นโควาเลนท์ หรือสารทำปฏิกิริยาที่เป็นก๊าซจะทำปฏิกิริยาได้เร็วกว่าสารที่มีสถานะอื่น
2. ความเข้มข้นสารตั้งต้น และผลิตภัณฑ์
ความเร็วของปฏิกิริยาจะแปรผันตามความเข้มข้นของสารตั้งต้น และจะแปรผกผันกับความเข้มข้นของสารผลิตภัณฑ์ กล่าวคือ เมื่อปริมาณสารตั้งต้นมีมากอัตราการเกิดปฏิกิริยาก็จะเร็ว และเมื่อเวลาผ่านไปปริมาณสารตั้งต้นลดลง ปฏิกิริยาก็จะค่อยๆลดลงตามปริมาณผลิตภัณฑ์ที่เพิ่มขึ้น
3. พื้นที่ผิว
พื้นที่ผิวของสารจะเป็นจุดของการเกิดปฏิกิริยา หากสารมีพื้นที่ผิวมากก็จะทำให้เกิดปฏิกิริยาได้เร็วขึ้น เช่น การทำปฏิกิริยาของหินปูนกับกรดไฮโดรคลอริกจะได้ก๊าซคาร์บอนไดออกไซด์ หากหินปูนมีความละเอียดเป็นผงขนาดเล็ก มีพื้นที่ผิวมากก็ย่อมทำปฏิกิริยากับกรดไฮโดรคลอริกได้อย่างรวดเร็ว
4. อุณหภูมิ
อุณหภูมิถือเป็นปัจจัยหนึ่งที่ช่วยกระตุ้นความเร็วของการเกิดปฏิกิริยา เช่น การอุ่นน้ำมันด้วยความร้อนเพียงน้อยนิดจะทำให้น้ำมันอุ่นเท่านั้น แต่หากเพิ่มความร้อนจนทำให้น้ำมันกลายเป็นไอก็สามารถลุกติดไฟได้ง่าย
5. ความดัน
ความดันที่เกี่ยวข้องกับอัตราการเกิดปฏิกิริยาเคมีมักพบมากในสารที่เป็นก๊าซ เพราะการเพิ่มความดันให้ก๊าซจะทำให้โมเลกุลของก๊าซเกิดการชนกันมากขึ้น
Homepage
แหล่งอ้างอิง : https://www.siamchemi.com/%E0%B8%9B%E0%B8%8F%E0%B8%B4%E0%B8%81%E0%B8%B4%E0%B8%A3%E0%B8%B4%E0%B8%A2%E0%B8%B2%E0%B9%80%E0%B8%84%E0%B8%A1%E0%B8%B5/



ความคิดเห็น
แสดงความคิดเห็น