อะตอมและตารางธาตุ
แบบจำลองอะตอม
แนวคิดในการพัฒนาแบบจำลองอะตอม.
ในสมัยโบราณมีนักปราชญ์ชาวกรีกชื่อ ดิโคริตุส (Democritus) เชื่อว่าเมื่อย่อยสารลงเรื่อย ๆ จะได้ส่วนที่เล็กที่สุดซึ่งไม่สามารถทำให้เล็กลงกว่าเดิมได้อีก และเรียกอนุภาคขนาดเล็กที่สุดว่า อะตอม ซึ่งคำว่า "อะตอม"(atom) เป็นคำซึ่งมาจากภาษากรีกว่า (atomas) แปลว่า แบ่งแยกอีกไม่ได้
สสารทั้งหลายประกอบด้วยอนุภาคที่เล็กที่สุด จะไม่สามารถมองเห็นได้และจะไม่สามารถแบ่งแยกให้เล็กลงกว่านั้นได้อีก แต่ในสมัยนั้นก็ยังไม่มีการทดลอง เพื่อพิสูจน์และสนับสนุนแนวความคิดดังกล่าว
แบบจำลองอะตอม (Atomic model) เป็นภาพทางความคิดที่แสดงให้เห็น รายละเอียดของโครงสร้างอะตอมที่สอดคล้อง กับผลการทดลองและใช้อธิบายปรากฏการณ์ ของอะตอมได้
แบบจำลองอะตอมของดอลตัน
อะตอมมีลักษณะทรงกลม และเป็นอนุภาคที่มีขนาดเล็กที่สุด ซึ่งแบ่งแยกไม่ได้ และไม่สามารถสร้างขึ้นใหม่หรือทำให้สูญหายได้
จอห์น ดอลตัน นักวิทยาศาสตร์ชาวอังกฤษ เป็นนักเคมีคนแรกที่เสนอแนวคิดเกี่ยวกับอะตอม ซึ่งมีสาระสำคัญดังนี้
ธาตุประกอบด้วยอนุภาคเล็ก ๆ หลายอนุภาค อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้สูญหายหรือสร้างขึ้นใหม่ไม่ได้
อะตอมของธาตุชนิดเดียวกันย่อมมีสมบัติเหมือนกัน มีมวลเท่าๆ กัน แต่มีสมบัติแตกต่างจากอะตอมของธาตุอื่น ๆ
สารประกอบเกิดจากอะตอมของธาตุมากกว่า 1 ชนิด ทำปฏิกิริยากันในอัตราส่วนที่เป็นเลขลงตัวอย่างง่าย
แบบจำลองอะตอมของทอมสัน
อะตอม ประกอบด้วย อนุภาคโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับประจุลบ
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด
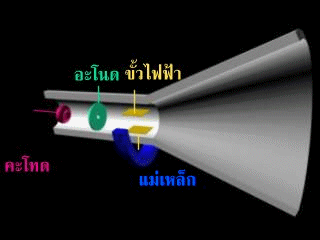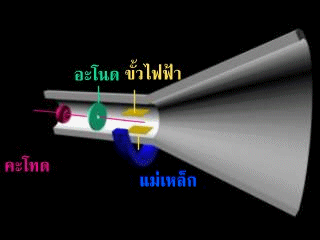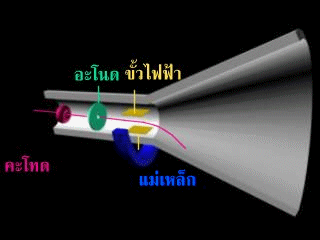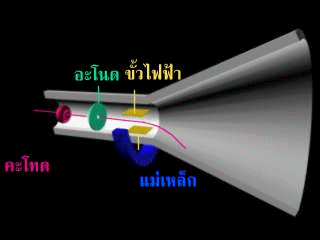
หลอดรังสีแคโทด.
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
การค้นพบอิเล็กตรอน
เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่ ดังรูป
รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะุลุออกไปกระทบกับฉากเรืองแสง
หลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทดดังรูป
ปรากฎว่า. รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า รังสีนี้ต้องเป็นประจุลบ แต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้ผลการทดลองเหมือนเดิม จึงสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป
ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ ไม่ได้เกิดจากขั้วไฟฟ้า
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ ไม่ได้เกิดจากขั้วไฟฟ้า
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอม ประกอบด้วย นิวเคลียสที่มีโปรตอนรวมอยู่ตรงกลาง มีขนาดเล็ก และมีมวลมาก และมีอิเล็กตรอนซึ่งมีมวลน้อยวิ่งอยู่รอบ ๆ นิวเคลียส
ลอร์อเออร์เนสต์ รัทเทอร์ฟอร์ด นักวิทยาศาสตร์ชาวอังกฤษ และฮันส์ ไกเกอร์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองยิงอนุภาคแอลฟาไปยังแผ่นทองคำบาง ๆ เรียกการทดลองนี้ว่าการทดลองการกระเจิงรังสีอัลฟาของรัทเทอร์ฟอร์ด ดังรูป
จากการทดลองพบว่า.
อนุภาคแอลฟาส่วนใหญ่วิ่งเป็นแนวเส้นตรงทะลุแผ่นทองคำบาง ๆ
อนุภาคแอลฟาบางส่วนวิ่งเบี่ยงเบนไปจากแนวเส้นตรง
อนุภาคแอลฟาส่วนน้อยสะท้อนกลับ
ดังนั้น. รัทเทอร์ฟอร์ด เชื่อว่า น่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ภายในนิวเคลียส ซึ่งไม่มีประจุ แต่มีมวลใกล้เคียงกับโปรตอน และทอมสันศึกษาหามวลของอนุภาคบวกของ Ne ปรากฎว่า อนุภาคบวกนี้มีมวล 2 เท่าผลการทดลองนี้สนับสนุนว่าจะต้องมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส เชดวิก ได้ยิงอนุภาคแอลฟาไปยัง Be ปรากฎว่าได้อนุภาคชนิดนึ่งออกมา ซึ่งมีมวลใกล้เคียงกับมวลของโปรตรอนและไม่มีประจุไฟฟ้า เรียกอนุภาคนี้ว่า"นิวตรอน"
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
อนุภาคมูลฐานของอะตอม
เลขมวล ( Mass number ) หมายถึง ผลบวกของโปรตอน และนิวตรอนในนิวเคลียส
เลขอะตอม ( Atpmic number ) หมายถึง จำนวนโปรตอนในนิวเคลียส ซึ่ง = จำนวนอิเล็กตรอนในอะตอม
A = Z + n (จำนวนนิวตรอน)
ไอออน (Ion) คือ อนุภาคที่มีประจุไฟฟ้า ซึ่งเกิดจากอะตอมเสียหรือได้รับอิเล็กตรอน ประจุไฟฟ้า มี 2 ชนิด ดังนี้
1. ไอออนบวก ( ation ) คือ อนุภาคที่มีโปรตอน มากกว่า อิเล็กตรอน
2. ไอออนลบ ( anion ) คือ อนุภาคที่มีโปรตอน น้อยกว่า อิเล็กตรอน
ไอโซโทป ( Isotope ) หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน
ไอโซโทน ( Isotone ) หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน
ไอโซบาร์ ( Isobar ) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน
ไอโซอิเล็กทรอนิกส์ ( Isoelectronic ) หมายถึง อะตอมของธาตุหรือไอออนที่มีจำนวนอิเล็กตรอนเท่ากัน
แบบจำลองอะตอมของนีลส์ โบร์
โบร์ได้ศึกษาแบบจำลองอะตอมขึ้นมาโดยนำแบบจำลองอะตอมของรัทฟอร์ดมาแก้ไข เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไป
ผลการทดลอง
อิเล็กตรอนเคลื่อนจากขั้วบวกไปขั้วลบชนกับแก๊สไฮโดรเจน จากนั้นเปล่งแสงออกมาผ่านปริซึมทำให้เราเห็นเป็นเส้นสเปกตรัมสีต่าง ๆ ตกบนฉากรับภาพ
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
สเปกตรัม
สเปกตรัมเป็นแสงที่ถูกแยกกระจายออกเป็นแถบสีต่าง ๆ และแสงเป็นรูปหนึ่งของคลื่นแม่เหล็กไฟฟ้า
แถบสีต่างๆในแถบสเปคตรัมของแสง
สเปกตรัมของธาตุ
แมกซ์ พลังค์ได้เสนอทฤษฎีควอนตัม (quantum theory) และอธิบายเกี่ยวกับการเปล่งรังสีว่า รังสีแม่เหล็กไฟฟ้าที่เปล่งออกมามีลักษณะเป็นกลุ่มๆ ซึ่งประกอบด้วยหน่วยเล็กๆ เรียกว่า ควอนตัม (quantum) ขนาดของควอนตัมขึ้นกับความถี่ของรังสี และแต่ละควอนตัมมีพลังงาน (E) โดยที่ E เป็นปฏิภาคโดยตรงกับความถี่ (u) ดังนี้
E=hν
E = พลังงาน 1 ควอนตัมแสง(J)
h = ค่าคงที่ของพลังค์ (6.62x10-34 Js)
ν= ค่าความถี่ ( s-1)
สรุปแบบจำลองอะตอมของโบร์
1. อิเล็กตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน”
2. อิเล็กตรอนที่อยู่ในระดับพลังงานวงนอกสุดเรียกว่า เวเลนซ์อิเล็กตรอน (Valent electron)จะเป็นอิเล็กตรอนที่เกิดปฏิกิริยา
ต่าง ๆ ได้
3. อิเล็กตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมากเพราะประจุบวกจากนิวเคลียสดึงดูดไว้อย่างดี ส่วน
3. อิเล็กตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมากเพราะประจุบวกจากนิวเคลียสดึงดูดไว้อย่างดี ส่วน
อิเล็กตรอนระดับพลังงานวงนอจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก
4. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
5. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับพลังงานกันก็ได้
4. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
5. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับพลังงานกันก็ได้
แบบจำลองอะตอมของกลุ่มหมอก
จากแบบจำลองอะตอมของโบร์ ไม่สามารถอธิบายสมบัติบางอย่างของธาตุที่มีหลายอิเล็กตรอนได้จึงมีการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาคการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาค
สรุปแบบจำลองอะตอมแบบกลุ่มหมอกแบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
สรุปแบบจำลองอะตอมแบบกลุ่มหมอกแบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
การจัดเรียงอิเล็กตรอนในอะตอม
ในแต่ละชั้นของระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้ ไม่เกิน 2n2
ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f
การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
การจัดอิเล็กตรอนในระดับพลังงานหลัก ทำให้แต่ละระดับพลังงานมีจำนวนอิเล็กตรอนมากจึงเกิดปัญหาว่าอิเล็กตรอนเหล่านั้นอยู่ในระดับพลังงานเดียวกันได้อย่างไร ทำไมจึงไม่ผลักกัน เพื่อแก้ปัญหาดังกล่าว นักวิทยาศาสตร์จึงได้ศึกษาเกี่ยวกับระดับพลังงานย่อยเพื่อกระจายอิเล็กตรอนในแต่ละระดับพลังงานหลัก เข้าสู่ระดับพลังงานย่อย โดยอาศัยรูปแบบโคจรของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นเกณฑ์ในการแบ่งอิเล็กตรอนเป็นกลุ่มย่อย ๆ และเรียกรูปแบบวงโคจรนี้ว่าออร์บิทัล (Orbital) โดย 1 ออร์บิทัลจะมีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน ระดับพลังงานย่อยมี 4 ระดับ คือ s, p, d, f โดยระดับพลังงานย่อยมี
s มี 1 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 2 อิเล็กตรอน
p มี 3 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 6 อิเล็กตรอน
d มี 5 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 10 อิเล็กตรอน
f มี 7 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 14 อิเล็กตรอน
การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
1.จัดอิเล็กตรอนในระดับพลังงานย่อยต่าง ๆ จะต้องจัดเข้าในระดับพลังงานย่อยที่มีพลังงานต่ำสุดก่อนแล้วจึงจัดเข้าสู่ระดับพลังงานย่อยที่มีพลังงานสูงขึ้น(ตามหลักของเอาฟบาว) ดังแผนผังต่อไปนี้
จากแผนภาพจัดเรียงอิเล็กตรอนเข้าสู่ระดับพลังงานย่อยได้ดังนี้
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
2. อิเล็กตรอน 2 ตัว ที่อยู่ในออร์บิทัลเดียวกัน จะต้องมีทิศทางการเคลื่อนที่สวนทางกันโดยแสดงทิศทางด้วยลูกศร
ตามหลักการของเพาลี
3. การจัดอิเล็กตรอนเข้าสู่ระดับพลังงานย่อย ถ้าอิเล็กตรอนบรรจุอยู่กึ่งหนึ่งหรือบรรจุเต็มออร์บิทัลจะมีโครงสร้างแบบเสถียร
การจัดเรียงอิเล็กตรอนแบบระดับพลังงานย่อยในรูปแก๊สเฉื่อย
ฮีเลียม (He) นีออน (Ne) อาร์กอน (Ar) คริปทอน (Kr) ซีนอน (Xe) และ เรดอน (Ra)
ข้อสังเกตที่ได้จากการใช้จัดเรียงอิเล็กตรอนในอะตอม
1. เลขอะตอมคู่จะอยู่ในหมู่คู่ เลขอะตอมคี่จะเป็นธาตุในหมู่คี่
2. ธาตุหมู่ IA และ IIA ตั้งแต่คาบ 3 ขึ้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 8 เสมอ
3. ธาตุหมู่ IIIA ถึง VIIIA ตั้งแต่หมู่ที่ IIIA คาบ 4 เป็นต้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 18 เสมอ
4. ถ้าธาตุนั้นมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามข้อ 2 และ 3 คือมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้น มีค่าตั้งแต่ 9 – 18 แต่วงนอกสุดมีเวเลนซ์อิเล็กตรอนเป็น 1 หรือ 2 นักเรียนก็ทำนายได้ทันทีว่าเป็นธาตุแทรนซิชัน
หมายเหตุ. ธาตุแทรนซิชันที่มีเลขอะตอมตั้งแต่ 21 – 30 จะมีเวเลนซ์อิเล็กตรอนเป็น 2 ยกเว้น Cu กับ Cr จะมีเวเลนซ์อิเล็กตรอนเป็น 1
ตารางธาตุ
วิวัฒนาการของการสร้างตารางธาตุ
โยฮันดน์ เดอเบอไรเนอร์ จัดธาตุเป็นกลุ่ม ๆ ละ 3 ธาตุ เรียกว่า ชุดสาม และพบว่าธาตุกลาง
จะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของธาตุแรกและธาตุหลังโดยประมาณ เช่น
Li มีมวล 6.9 Na มีมวล 23.0 K มีมวล 39.1
มวลอะตอม Na = = 23
มีบางกลุ่มที่มวลอะตอมของธาตุตรงกลางไม่เท่ากับค่าเฉลี่ยของธาตุสองธาตุที่เหลือ หลักชุดสามของเดอเบอร์ไรเนอร์จึงไม่เป็นที่ยอมรับ
จอห์น นิวแลนด์ส ได้เสนอกฎว่า ถ้านำธาตุมาเรียงลำดับตามมวลอะตอมจะพบว่าธาตุที่ 8 มีสมบัติคล้ายกับธาตุที่ 1 โดยเริ่มจากธาตุใดก็ได้
แต่ไม่รวมก๊าซเฉื่อย แต่กฎนี้ใช้ได้ถึงธาตุแคลเซียมเท่านั้น และไม่สามารถอธิบายได้ว่า เหตุใดมวลอะตอมจึงมาเกี่ยวข้องกับความคล้ายคลึงกันของธาตุได้
มนเดเลเอฟและไมเออร์ ได้ตั้งข้อสังเกตอย่างเดียวกันในเวลาใกล้เคียงกันว่าถ้าเรียงธาตุตามลำดับมวลอะตอมจากน้อยไปหามาก จะพบว่าธาตุมีสมบัติคล้ายคลึงกันเป็นช่วง ๆ การที่ธาตุต่าง ๆ มีสมบัติคล้ายคลึงกันเป็นช่วงเช่นนี้ เมนเดเลเอฟ ตั้งเป็นกฎเรียนว่า “กฎพีริออดิก” และได้เผยแพร่ความคิดนี้ในปี พ.ศ. 2412 (ค.ศ. 1869) ก่อนที่ไมเออร์จะพิมพ์ผลงานของเขาออกมาหนึ่งปี เพื่อให้เกียรติแก่เมนเดเลเอฟ จึงเรียกว่า ตารางพีริออดิกของเมนเดเลเอฟ
เมนเดเลเอฟได้จัดธาตุที่มีสมบัติคล้ายคลึงกันที่ปรากฏซ้ำกันเป็นช่วง ๆ ให้อยู่ในแนวดิ่ง หรือในหมู่เดียวกันและพยายามเรียงลำดับมวลอะตอมของธาตุจากน้อยไปหามาก ถ้าเรียงตามมวลอะตอมแล้วสมบัติไม่สอดคล้องกัน ก็พยายามจัดให้เข้าหมู่โดยเว้นช่องว่างไว้ ซึ่งเขาคิดว่าช่องว่างเหล่านั้นน่าจะเป็นตำแหน่งของธาตุที่ยังไม่มีการค้นพบ และยังได้ใช้สมบัติของธาตุและสารประกอบอื่น ๆ นอกเหนือจากคลอไรด์และออกไซด์มาประกอบการพิจารณาด้วย โดยที่ตำแหน่งของธาตุในตารางธาตุมีความสัมพันธ์กับสมบัติของธาตุ เมนเดเลเอฟจึงสามารถทำนายสมบัติของธาตุในช่องว่างใต้ซิลิคอนได้อย่างใกล้เคียงดังตาราง
เฮนรี โมสลีย์ พบว่าการเรียงธาตุตามลำดับเลขอะตอม หรือจำนวนโปรตอนมีความสัมพันธ์กับสมบัติของธาตุนั้น และขึ้นอยู่กับการจัดเรียงตัวของอิเล็กตรอนในอะตอมของธาตุนั้น ๆ
ตารางธาตุปัจจุบัน
1. ธาตุในแต่ละหมู่และแต่ละคาบมีจำนวนไม่เท่ากัน
หมู่ A เรียกว่า ธาตุเรพรีเซนเตตีฟ
หมู่ B เรียกว่า ธาตุแทรนซิชัน เป็นธาตุที่อยู่ระหว่างหมู่ IIA และ IIIA 2. ธาตุทางซ้ายมือ
ของเส้นหนักเป็นขั้นบันได มีสมบัติเป็นโลหะและธาตุทางขวาของเส้นจะเป็นอโลหะ
ส่วนธาตุที่อยู่ชิดเส้นแบ่งนี้จะเป็นธาตุกึ่งโลหะ คือ B , Si , Ge , As , Sb และ Te
2. ธาตุหมู่ A เลขประจำหมู่บ่งบอกถึงจำนวนเวเลนต์อิเล็กตรอน
เช่น หมู่ IA มีเวเลนต์อิเล็กตรอนท่ากับ 1 คือธาตุ Li Na K Rb Cs Fr เป็นต้น
3. ธาตุในคาบเดียวกันจะมีจนวนระดับพลังงานเท่ากัน เช่น
ธาตุคาบที่ 1 มีจำนวนระดับพลังงาน 1 ระดับได้แก่ ธาตุ H He เป็นต้น
ตารางธาตุที่ใช้กันอยู่ในปัจจุบันนั้น มีการจัดเรียง คือ
1. จัดเรียงธาตุตามแนวนอนโดยเรียงลำดับเลขอะตอมที่เพิ่มขึ้นจากซ้ายไปขวา
2.ธาตุซึ่งเรียงตามลำดับเลขอะตอมที่เพิ่มขึ้นและเป็นแถวตามแนวนอนเรียกว่า คาบ ซึ่งมีทั้งหมด 7 คาบ ได้แก่
- คาบที่ 1 มี 2 ธาตุ คือ H และ He
- คาบที่ 2 มี 8 ธาตุ คือ Li จนถึง Ne
- คาบที่ 3 มี 8 ธาตุ คือ Na จนถึง Ar
- คาบที่ 4 มี 18 ธาตุ คือ K จนถึง Kr
- คาบที่ 5 มี 18 ธาตุ คือ Rb จนถึง Xe
- คาบที่ 6 มี 32 ธาตุ คือ Cs ถึง Rn
- คาบที่ 7 มี 29 ธาตุ(ที่ค้นพบ) คือ Fr จนถึง Ds และ Uuu Uub Uuq Uuh Uu
3. ธาตุในแถวตามแนวตั้ง มีทั้งหมด 18 แถว เรียกว่า หมู่ ซึ่งมีตัวเลขกำกับ แบ่งออกเป็นหมู่ย่อย A และ B โดยที่
หมู่ย่อย A มี 8 หมู่ คือ หมู่ I A จนถึง VIII A (หมู่ O) และในหมู่ย่อยต่างๆ ของหมู่ A ก็มีชื่อเรียกเฉพาะ โดย
- หมู่ I A มีชื่อว่า โลหะอัลคาไล
- หมู่ II A มีชื่อว่า โลหะอัลคาไลน์ เอิร์ธ
- หมู่ VI A มีชื่อว่า คาลโคเจน
- หมู่ VII A มีชื่อว่า แฮโลเจน
- หมู่ VIII A มีชื่อว่า ก๊าซมีตระกูล (Noble Gas) หรือ ก๊าซเฉื่อย (Inert Gas)
หมู่ย่อย B มี 8 หมู่ คือ หมู่ I B จนถึง VIII B แต่เรียงเริ่มจากหมู่ III B ถึงหมู่ II B ซึ่งมีชื่อเรียกว่า ธาตุแทรซิชัน (Transition Elements)
4. ส่วนธาตุ 2 แถวล่าง ซึ่งแยกไว้ต่างหากนั้น เรียกว่า ธาตุแทรนซิชันชั้นใน (Inner transition elements)
ธาตุแถวบนคือธาตุที่มีเลขอะตอมตั้งแต่ 58 ถึง 71 เรียกว่า กลุ่มธาตุแลนทาไนด์ (Lanthanide series) ธาตุกลุ่มนี้ควรจะอยู่ในหมู่ III B โดยจะเรียงต่อจากธาตุ La
ส่วนแถวล่าง คือ ธาตุที่มีเลขอะตอมตั้งแต่ 90 ถึง 103 เรียกว่า กลุ่มธาตุแอกทิไนด์ (Actinide series) ธาตุกลุ่มนี้ควรอยู่ในหมู่ III B โดยเรียงต่อจากธาตุ Ac
5. ธาตุไฮโดรเจนมีสมบัติบางอย่างคล้ายธาตุหมู่ 1 และมีสมบัติบางอย่างคล้ายธาตุหมู่ 7 จึงแยกไว้ต่างหาก
6. ธาตุที่เป็นโลหะและอโลหะถูกแยกออกจากกันด้วยเส้นหนักขั้นบันได โดยทางซ้ายของเส้นบันไดเป็นโลหะ ทางขวาของเส้นขั้นบันไดเป็นอโลหะ ส่วนธาตุที่อยู่ชิดเส้นบันไดจะมีสมบัติก้ำกึ่งระหว่างโลหะกับอโลหะ เรียกธาตุพวกนี้ว่า ธาตุกึ่งโลหะ (Metalloid) ได้แก่ โบรอน (B) ซิลิคอน (Si) เจอร์เมเนียม (Ge) อาร์เซนิกหรือสารหนู (As) แอนติโมนีหรือพลวง (Sb) และเทลลูเรียม (Te)
การอ่านชื่อธาตุที่มีเลขอะตอมมากกว่า 105 โดยระบุเลขอะตอมเป็นภาษาละติน แล้วลงท้ายด้วย -ium
จำนวนนับในภาษาละตินมีดังนี้
0 = (nil) 1 = (un)
2 = (bi) 3 = (tri)
4 = (quad) 5 = (pent)
6 = (hex) 7 = (sept)
8 = (oct) 9 = (enn)
เช่น ธาตุที่ 105 อ่านว่า Unnilpentium สัญลักษณ์ธาตุ Unp
เลขออกซิเดชัน
คือ ค่าประจุของแต่ละอะตอม (ถ้าถือว่าการถ่ายโอนอิเล็กตรอนเกิดขึ้นอย่างสมบูรณ์) ในโมเลกุล โดยมีหลักการในการกำหนดเลขออกซิเดชัน ดังนี้
1. เลขออกซิเดชันของธาตุอิสระมีค่าเป็น 0 เช่น Na, O2 และ P4
2. โลหะแอลคาไล (alkali metal = หมู่ IA) มีเลขออกซิเดชันเป็น +1
โลหะแอลคาไลน์เอิร์ท (หมู่ IIA) มีเลขออกซิเดชันเป็น +2
3. H มีเลขออกซิเดชันเป็น +1 ยกเว้นเมื่อเป็นสารประกอบโลหะไฮไดรด์ เช่น NaH อะตอมของธาตุ H มีเลขออกซิเดชันเป็น -1
4. O มีเลขออกซิเดชันเป็น -2 ยกเว้นในสารประกอบเปอร์ออกไซด์ (peroxide) และสารประกอบซูเปอร์ออกไซด์ (superoxide)
– สารประกอบเปอร์ออกไซด์ เช่น H2O2 อะตอมของธาตุ O มีเลขออกซิเดชันเป็น -1 และ
– สารประกอบซูเปอร์ออกไซด์ เช่น Na2O อะตอมของธาตุ O มีเลขออกซิเดชันเป็น -1/2
5. เลขออกซิเดชันของไอออนอะตอมเดี่ยวมีค่าเท่ากับประจุของไอออนนั้น เช่น
– Na+ มีเลขออกซิเดชันเป็น +1
– O2– มีเลขออกซิเดชันเป็น -2
เลขออกซิเดชันของไอออนที่เป็นหมู่อะตอมมีผลรวมของเลขออกซิเดชันเท่ากับประจุของไอออนนั้น เช่น
– SO42- อะตอมของธาตุ S มีเลขออกซิเดชันเป็น +6 และอะตอมของธาตุ O มีเลขออกซิเดชันเป็น -2
6. ผลรวมของเลขออกซิเดชันของสารที่เป็นกลางทางไฟฟ้ามีค่าเป็น 0 เช่น
– NaCl อะตอมของธาตุ Na มีเลขออกซิเดชันเป็น +1 และ อะตอมของธาตุ Cl มีเลขออกซิเดชันเป็น -1 ส่วน
– HNO3 อะตอมของธาตุ H มีเลขออกซิเดชันเป็น +1 อะตอมของธาตุ N มีเลขออกซิเดชันเป็น +5 และอะตอมของธาตุ O มีเลขออกซิเดชัน เป็น -2
เลขออกซิเดชันกับตารางธาตุ
เลขออกซิเดชันของธาตุต่าง ๆ เมื่อเกิดเป็นสารประกอบ แสดงในตารางต่อไปนี้ เลขออกซิเดชันที่มีสีแดงเป็นเลขออกซิเดชันที่พบเป็นส่วนใหญ่
Homepage
แหล่งอ้างอิง : http://thn25115-chem4.blogspot.com/2017/09/1.html




























ความคิดเห็น
แสดงความคิดเห็น